Material
- 2 dos o tres cucharadas de una solución de sulfato de cobre
- Frasco o vaso
- Amoniaco
Procedimiento
Vertemos en un vaso una solución de sulfato de cobre le añadimos poco a poco amoniaco diluído mientras agitamos la mezcla.
¿Que sucede?
Al principio se entrubia (blanquecino) y luego aparece un color azul violeta.
Explicación
Teniendo esa solución color azul celeste en un vaso o frasco de vidrio incoloro, le agregamos de a poco y agitando una solución de amoníaco: veremos que al principio se enturbia el líquido porque se forma hidróxido de cobre, blanquecino, que no se disuelve en agua. Pero si seguimos agregando amoníaco, aparece un hermoso color azul violáceo debido a que se forma Cu(NH3)4++.
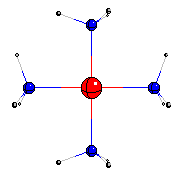 | Ese ion tiene la forma de un cuadrado con el ion cobre con dos cargas positivas (Cu++) en el centro y una molécula de amoníaco (NH3) en cada vértice, como se ve en la figura. Si agregamos un poco de solución de ácido ascórbico (preparada disolviendo una pastilla de 1 gramo de vitamina C en 6 o 7 cucharadas de agua), el color casi desaparece. Y si calentamos ligeramente la solución y la dejamos reposar, veremos que se forma un depósito rojizo de cobre metálico como un polvo fino. Eso ocurre porque el ácido ascórbico reduce (le cede electrones, que tienen carga negativa) al Cu++ , que entonces se neutraliza y pasa a cobre metálico. Velay!... |