Material
- 3,3 g de nitrato de plomo II, Pb(NO3 )2 , disueltos en un litro de agua.- 3,3 g de yoduro de potasio, Kl, disueltos en un litro de agua.- dos tubos de ensayo.- dos pipetas de 5 cm 3 .- un mechero de gas para calentar el tubo de ensayo, con las correspondientes pinzas. Procedimiento Si ponemos en contacto el yoduro de potasio y el nitrato de plomo II, se transforman en nitrato de potasio, KNO3, y yoduro de plomo II, Pbl2. Este proceso está descrito por la ecuación:
2 Kl +Pb(NO3 )2 = 2 KNO3 +Pbl2 (precipita)
Disuelve los 3,3 g de cada sal en un litro de agua, en botellas separadas. Toma, con pipetas distintas, 5 cm 3 de cada disolución y viértelos en cada tubo de ensayo. Echa el contenido de un tubo en el otro. El aspecto transparente de cada reactivo se convierte en amarillo turbio. Es el yoduro de plomo II que precipita.
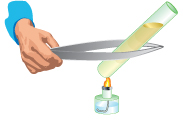
Calienta con cuidado el tubo de ensayo con la llama del mechero, paseando el tubo por la llama con un movimiento de vaivén. No sigas calentando cuando comience a hervir. En este momento el aspecto se volverá casi transparente: como casi todos los sólidos, el yoduro de plomo II se disuelve mejor en agua caliente que en agua fría. Espera unos instantes y pon el tubo debajo del grifo del agua fría, con cuidado de que no entre agua en el tubo. En pocos minutos se verán unas pequeñas escamas doradas moviéndose en el agua. Es el yoduro de plomo II de nuevo. ¡Parecen de oro! Explicación El compuesto que precipita es amarillo y es que da lugar al fenómeno de la lluvia dorada.
- 3,3 g de nitrato de plomo II, Pb(NO3 )2 , disueltos en un litro de agua.
- 3,3 g de yoduro de potasio, Kl, disueltos en un litro de agua.
- dos tubos de ensayo.
- dos pipetas de 5 cm 3 .
- un mechero de gas para calentar el tubo de ensayo, con las correspondientes pinzas.
Procedimiento
Si ponemos en contacto el yoduro de potasio y el nitrato de plomo II, se transforman en nitrato de potasio, KNO3, y yoduro de plomo II, Pbl2. Este proceso está descrito por la ecuación:
2 Kl +Pb(NO3 )2 = 2 KNO3 +Pbl2 (precipita)
Disuelve los 3,3 g de cada sal en un litro de agua, en botellas separadas. Toma, con pipetas distintas, 5 cm 3 de cada disolución y viértelos en cada tubo de ensayo. Echa el contenido de un tubo en el otro. El aspecto transparente de cada reactivo se convierte en amarillo turbio. Es el yoduro de plomo II que precipita.
Calienta con cuidado el tubo de ensayo con la llama del mechero, paseando el tubo por la llama con un movimiento de vaivén. No sigas calentando cuando comience a hervir. En este momento el aspecto se volverá casi transparente: como casi todos los sólidos, el yoduro de plomo II se disuelve mejor en agua caliente que en agua fría. Espera unos instantes y pon el tubo debajo del grifo del agua fría, con cuidado de que no entre agua en el tubo. En pocos minutos se verán unas pequeñas escamas doradas moviéndose en el agua. Es el yoduro de plomo II de nuevo. ¡Parecen de oro!
Explicación
El compuesto que precipita es amarillo y es que da lugar al fenómeno de la lluvia dorada.